随着制药工业的快速发展,药物质量控制的要求日益严格,不仅关注药物的主成分含量更强调对痕量杂质的准确分析与严格管控。杂质的种类多样,既包括无机阴离子、金属离子等无机杂质,也涵盖了药物在合成、贮存及使用过程中的有机降解产物及副产物。近年发展迅猛的离子色谱法,因其在检测离子性、极性及微量杂质方面具有高灵敏度、高选择性和强分离能力,而日渐成为药物分析与质量控制的关键手段[1]。
1离子色谱法的基本原理与方法优化
1.1离子色谱法的工作原理
离子色谱法主要利用固定相对目标离子或带电化合物的选择性吸附、交换或排斥作用,实现不同离子的分离。其核心部件通常包括分离柱、抑制器、检测器以及输液系统,离子交换色谱是离子色谱最常见的模式,分离柱通常填充有离子交换树脂,树脂表面带有固定的功能基团,如阴离子交换树脂表面带有季铵基团可与带负电的阴离子形成静电相互作用;阳离子交换树脂表面则带有磺酸基团,用于保留阳离子。在分离过程中流动相与样品共同通过分离柱,不同离子或极性分子在树脂上的保留时间不同从而实现有效分离。在检测方面离子色谱常配备电导检测器、紫外检测器或抑制电导检测系统等,其中以抑制电导检测器最为常见,这种检测模式通过利用抑制器将流动相中的背景电导大幅度降低,使得样品中目标离子的电导信号更加突出从而获得更高的检测灵敏度,近年来随着分析任务复杂程度的不断提高,离子色谱开始与其它分析技术联用,如与质谱联用(IC-MS)及与ICP-MS联用(IC-ICP-MS),极大提升了对多类型杂质的检出能力和定性定量准确度。
1.2流动相与固定相的选择
在离子色谱法中,流动相通常由缓冲溶液或酸碱溶液组成,用以调控目标离子与固定相的相互作用强度。对于阴离子分析而言常用的流动相包括碳酸盐缓冲液、碳酸氢盐缓冲液及氢氧化钠溶液等;对于阳离子检测,则可选用稀酸或含胺类缓冲液作为流动相。通过调整流动相的离子强度或pH,可实现对保留时间及分离度的精细调控。固定相的选择主要取决于分离目标物的性质。离子交换树脂通常使用聚合物基质,如聚苯乙烯-二乙烯基苯(PS-DVB),在其表面或内部接枝功能基团。阴离子交换柱和阳离子交换柱的交换容量、粒径、孔径以及表面功能基团密度都会显著影响分离效果,近几年一些新型固定相材料不断涌现,如单分散性高交联树脂、纳米纤维或多孔微球等,为提高分离度、缩短分析时间及增强柱耐用性提供了更多选择[2]。
1.3样品前处理策略
首先,对于样品的溶解性问题需要选择合适的溶剂或缓冲液,以保证杂质能够完全溶解并进入待测体系。其次,为去除样品中的蛋白、脂质或大分子杂质,常可采用离心、过滤或固相萃取等方式进行初步净化,对含有金属离子的样品还可通过螯合剂或除金属试剂进行预处理,以减少基质干扰并防止金属离子在仪器系统中的积累。在实际应用中还需要考虑分析对象的极性与电荷性质。对于阴离子分析可能需要在前处理阶段用酸化或碱化步骤,以确保目标阴离子以游离态存在;对于阳离子分析,则可能利用离子交换的方式进行富集或净化,值得注意的是,前处理过程中应尽量避免引入新的杂质或改变目标杂质的形态,以保证检测结果的准确与可靠。
2离子色谱法在药物杂质检测中的应用
2.1药品中无机杂质的检测
2.1.1采用阴离子色谱柱分离,优化电导检测参数
在制药过程中由于原料、辅料或生产工艺的影响,药品中常残留一定量的无机阴离子,例如氯离子、硫酸根离子、硝酸根离子、磷酸根离子等。此类无机杂质若不加以有效监测与控制可能对药物的安全性和稳定性造成不利影响,离子色谱法采用阴离子交换柱结合电导检测,对于上述阴离子具有很高的灵敏度和分离效率。在阴离子色谱法中,抑制电导检测器通过降低流动相背景电导,使得样品中阴离子信号更为突出,为获取最佳的检测灵敏度需要针对电导检测器的温度、抑制器的类型与流动相的离子强度进行优化。例如,近年来有研究人员使用氢氧化钠梯度洗脱体系,以在线淋洗液发生器实时配制浓度稳定的氢氧化钠溶液,从而在低背景离子强度下实现对一系列常见阴离子的高分辨分离[3]。在具体的参数优化上需要控制抑制器的工作温度在30~40℃之间,并根据不同的色谱柱特性及样品组成,确定最佳的氢氧化钠浓度梯度及流速,为了更好地适应药品中复杂基质所造成的基线干扰,可结合前处理手段如SPE或微滤膜等,去除可能与阴离子交换树脂产生竞争或干扰的成分。部分学者在研究中提出,可借助二维离子色谱来提高复杂背景下的分离度,将第一维色谱对样品中主要无机阴离子进行初步分离,随后在第二维色谱对微量或者难分离的阴离子进行进一步分离,从而达到更高的检测灵敏度与准确度。
2.1.2采用IC-ICP-MS联用技术定量金属杂质
金属杂质在药品中的存在可能源于生产过程中使用的金属催化剂、制备设备的磨损或原料药本身所含的痕量金属离子,此类金属杂质一旦超标可能对人体健康造成潜在危害,各国药典均对重金属和元素杂质提出了严格的限度要求,IC-ICP-MS联用技术则通过先在离子色谱系统中将不同金属离子或其配合物实现分离,然后再进入ICP-MS进行灵敏的元素检测,从而在同一体系中实现多种金属杂质的定性定量分析,在IC-ICP-MS联用中常采用阳离子交换柱分离金属阳离子,如钙、镁、钾、钠等常量元素以及铅、镉、砷等重金属离子,随后洗脱出的金属组分进入ICP-MS,利用其高灵敏度和多元素同时检测优势得到各元素的准确定量结果,在方法学验证时需要关注方法的线性范围、检测限与定量限等关键参数,同时结合内标校正或标准加入法来消除基体干扰。
2.2药品降解产物的分析
2.2.1采用梯度洗脱优化有机酸类降解产物的分离
药物在储存或使用过程中可能发生水解、氧化或其他化学反应,生成一系列有机酸性降解产物,此类降解产物不仅会影响药物的疗效还可能产生毒副作用因此对降解产物的检测和分析是药物质量控制的重要环节,离子色谱法对于含酸性官能团的降解产物具有良好的选择性和分辨率,尤其在有机酸与无机阴离子共存时仍能实现较好的分离[4]。梯度洗脱是近年来在离子色谱中应用日益广泛的技术在分析过程中逐步提高流动相中氢氧化物或碳酸盐浓度,可将保留较强的有机酸降解产物与保留较弱的无机阴离子依次洗脱,从而获得更高的分离度。基于在线淋洗液发生技术,研究者可精确设定不同时间点的流动相浓度避免人工配制中存在的误差,比如在分析某些含有多种羧酸基团或磺酸基团的降解产物时,合理设计梯度程序可避免峰拖尾与峰重叠,从而减少干扰提升定量准确度。样品前处理多采用液液萃取或SPE,去除药物中的中性杂质和大分子组分;若需区分多个酸性降解产物,可根据保留时间顺序或进一步通过高分辨质谱联用获得确证。近年的研究表明,通过对梯度洗脱条件如流速、初始和终止流动相浓度及梯度时间的系统优化,可在一个测试周期内分离检测十几种不同的有机酸,极大地提高了分析效率,这种基于离子色谱的梯度洗脱方法逐渐成为检测药物酸性降解产物的首选方案,如表1。
表1 不同梯度洗脱条件下有机酸类降解产物的分离效果对比表
序号 |
化合物名称 |
梯度条件A保留时间 |
梯度条件B保留时间 |
梯度条件C保留时间 |
梯度C分离度 |
梯度C峰面积(μS·min) |
1 |
乙酸 |
2.35min |
2.22min |
2.1min |
2.1Rs |
185.4 |
2 |
丙酸 |
3.1min |
2.95min |
2.88min |
2.5Rs |
172.3 |
3 |
丁酸 |
4.25min |
4.02min |
3.85min |
3Rs |
143.6 |
4 |
乳酸 |
5.6min |
5.2min |
4.9min |
2.8Rs |
160.8 |
5 |
草酸 |
6.95min |
6.3min |
5.7min |
3.5Rs |
210.2 |
6 |
柠檬酸 |
9.4min |
8.7min |
8.05min |
4Rs |
198.6 |
表1中列出了六种常见有机酸在不同梯度淋洗条件(A、B、C)下的保留时间、分离度及在梯度C条件下的峰面积数据,结果显示随着碳链长度和分子极性的变化,各化合物在离子色谱柱中的保留时间存在显著差异。在梯度条件C下各组分的保留时间依次延长,乙酸最短,柠檬酸最长表明梯度C具备良好的分离效果。柠檬酸与草酸的分离度最高,说明在该条件下可实现复杂有机酸混合物的有效分离,此外峰面积反映了各化合物的电导响应强度,草酸信号最强,丁酸最低为后续定量分析和杂质检测提供了依据,总体而言梯度C在分离效果和灵敏度方面表现最佳,适用于复杂有机酸体系的分析。
2.2.2结合高分辨质谱进行结构解析
对于复杂降解产物的鉴定,仅凭离子色谱的保留时间和电导检测响应往往不足以确切辨别其分子结构。将离子色谱与高分辨质谱(High-Resolution Mass Spectrometry,HRMS)联用,可以在分离的基础上实现对杂质的准确分子量测定并通过碎片离子信息推断其结构,近年来此类IC-HRMS技术已成为降解产物结构解析的重要手段,为药物杂质研究提供了新的发展方向。离子色谱与高分辨质谱的联用,多采用电喷雾电离(Electrospray Ionization,ESI)接口。在ESI源中,酸性降解产物通常以负离子模式离子化,与流动相的阴离子背景相兼容性较高,通过优化离子源电压、气体流量及离子传输参数,可显著提高检测灵敏度并降低基线噪音,IC-HRMS有助于对分子量相近、结构相似的降解产物进行区分,通过高分辨质谱下精确的m/z比以及二级碎片图谱,可以推测出降解产物的主要碎片路径和可能的化学骨架。
例如,有研究利用IC-OrbitrapMS技术对某抗生素制剂在不同pH条件下的降解产物进行分析,通过准确测得降解产物分子离子峰及相应碎片离子,成功推断出多个新型降解杂质的结构,并证实了主要降解途径包括开环反应及水解反应,为药企和监管机构及时发现潜在安全风险提供更敏感、更可靠的手段[5]。
2.3药物合成过程中的杂质控制
2.3.1采用离子色谱-电感耦合等离子体质谱进行微量金属杂质检测
在药物合成过程中,为加快反应速率或提高产率,常使用金属催化剂或金属试剂,这也成为药物中金属杂质的主要来源。微量金属杂质若无法完全去除,可能对人体造成严重毒性或过敏风险。近年来,各国药典和ICH指南陆续更新,对金属杂质提出了更为严格的限度要求,推动了分析检测技术的不断完善[6]。
离子色谱-电感耦合等离子体质谱作为当前痕量金属检测的高端技术组合,在药物合成过程的质量控制中发挥了重要作用。例如,在某新型含氮杂环结构的抗菌原料药合成过程中,使用了多种金属试剂和催化剂,包括钯催化的交叉偶联反应、铂络合促进的重排反应及铜盐辅助的羟化反应。为确保成品中金属杂质含量符合ICHQ3D《元素杂质指导原则》的限度要求,研究团队采用离子色谱-电感耦合等离子体质谱联用技术对最终原料药中的钯、铂和铜残留进行了定量检测。如表2。
表2 检测结果
元素 |
ICHQ3D限度 (μg/g) |
检测浓度 (μg/g) |
方法检出限 (LOD,μg/g) |
分离保留时间 |
Cu |
25 |
2.13 |
0.05 |
3.2min |
Pd |
10 |
0.74 |
0.02 |
5.8min |
Pt |
10 |
<0.05(未检出) |
0.01 |
7.1min |
分析中采用IonPacCS5A阳离子交换柱,以乙二胺四乙酸(EDTA)为络合剂构建流动相(PH4.5),通过络合增强金属离子的分离选择性,进样体积设为50µL并在柱前配置多孔基体去除装置以清除氯离子和硫酸根等干扰基团。ICP-MS系统以多元素扫描模式运行,分别监测Cu、Pd及Pt信号,结果显示API-XY01样品中铜、钯、铂的残留浓度分别为2.13μg/g、0.74μg/g和未检出(<0.05μg/g),均远低于ICHQ3D中规定的限度值,方法的检出限分别为0.05、0.02和0.01μg/g,具备良好的灵敏度和准确度。色谱保留时间分别为3.2min(Cu)、5.8min(Pd)和7.1min(Pt),各组分峰形对称,分离度良好。IC-ICP-MS不仅可在复杂药物基体中实现多种金属杂质的同时分离与定量,而且通过优化流动相组成和柱前处理系统,能够有效降低基体干扰,提高方法稳定性与灵敏度,该技术已成为当前药物合成过程中金属杂质控制的重要手段,为确保药品质量安全提供了可靠的数据支持和技术保障。
2.3.2结合二维离子色谱提高复杂体系下杂质分离度
在药物合成过程中,尤其是多步合成与杂环化合物合成,常产生结构多样、性质相似的中间体与副产物,这些杂质的分离和检测难度较高。单一维的离子色谱有时无法满足分离要求,导致不同组分在色谱峰上重叠,从而影响定量准确度与可靠性。二维离子色谱(2D-IC)通过将第一维与第二维色谱柱联用,可显著提升分离度与选择性,使分析得到极大扩展。在2D-IC系统中,通常在第一维进行较宽范围的分离,针对目标离子或杂质群进行初步区分,例如,第一维使用阴离子交换模式,将样品中主要阴离子和部分有机酸性杂质初步分离,第二维则可采用不同树脂或阳离子交换模式继续分离残余的金属离子、胺类或某些特殊阴离子。2D-IC对于复杂药物基质或多成分体系尤为适用,如多肽合成过程中的多种氨基酸衍生物、核苷药物合成过程中的硫化物或含卤素副产物等。通过在线检测或离线收集分段模式,可使分析者在合成流程的不同阶段实时监控杂质水平,并及时调整工艺参数。文献报道显示,已有多项研究在小分子仿制药及大分子生物药的杂质剖析中成功应用了2D-IC技术,既提升了分离效率,又降低了分析时间和溶剂消耗,为药物合成过程中的品质管控提供了更加完善的解决方案[7]。
3离子色谱法在药物杂质检测中的方法学优化
3.1检测限与定量限优化
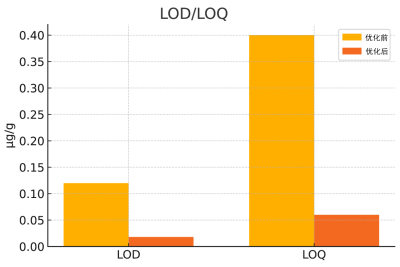
图1:LOD/LOQ优化前后对比
在药物杂质检测中,提高方法的灵敏度至关重要,通常需要将检出限(Limitof Detection,LOD)和定量限(Limitof Quantitation,LOQ)控制在极低水平,以满足对痕量杂质的监管要求。对于离子色谱法而言,影响LOD与LOQ的因素包括仪器本身的灵敏度、系统噪音水平、分离度以及样品前处理的损失等,例如某团队为验证离子色谱法在痕量金属杂质检测中的灵敏度优化效果,在API-XY01原料药检测过程中,对IC-ICP-MS方法的LOD和LOQ进行了系统评估与优化。以钯为代表性金属杂质,在初始方法中其LOD为0.12μg/g,LOQ为0.40μg/g,无法满足部分严格监管场景中对≤0.1μg/g的检测需求。为此,研究人员从多个层面开展方法优化。首先,在仪器端通过更换高灵敏度电感耦合等离子体质谱探测器并调整检测参数,有效提升了信噪比。其次,在色谱条件方面优化流动相组成,引入低金属背景的EDTA配合物体系并将PH调整至5.2,使Pd-EDTA络合物在柱内获得更高保留能力与更好分离度从而减少与其他杂质峰的重叠,在样品处理方面引入固相萃取(SPE)净化步骤,有效去除高盐基体与有机杂质,避免了进样过程中对色谱柱和质谱接口的干扰。进样体积也由原方案的50μL提高至100μL以增加信号强度,检测结果经过稀释线性验证确保不引入柱过载风险,优化后方法的Pd检测限降低至0.018μg/g,定量限为0.060μg/g,较原方法提升约6倍,该方法在加标回收实验中表现良好,回收率维持在95.8%~102.1%之间,RSD<3%,表明其具备良好的灵敏度和重复性,该优化方案成功应用于三批次API-XY01中残留钯的测定,检测值均<0.08μg/g显著优于ICHQ3D中设定的10μg/g限度,合理选择检测器类型、改进色谱条件、优化前处理方法及调节进样参数,可显著提升离子色谱法的检测灵敏度,满足新药研发与上市后质量控制中对金属杂质更为严格的定量要求。如图1。
3.2回收率及重复性分析
方法学验证中回收率与重复性是衡量离子色谱法能否稳定、准确地测定药物杂质的重要指标。回收率通常通过向已知含量的空白基质或药物中添加标准杂质,经过与实际样品相同的前处理和检测流程后,比较测得结果与理论加入量之间的偏差来评估[8]。重复性分析则需考察同一操作人员或不同操作人员在不同时段采用相同仪器、相同方法对同一样品的测定情况。若相对标准偏差过大,往往意味着方法的稳健性不足,可能源于流动相配制不稳定、柱温波动或进样系统精密度不佳等,基于此研究者在实际应用中应尽量标准化操作过程,如采用在线淋洗液发生器减少手动配制误差,使用恒温箱对柱温及管路温度进行控制定期校正检测器并更换易损部件等。
对于金属杂质检测,回收率还与金属离子在前处理步骤中的化学形态变化密切相关。比如,螯合剂的选择需要与检测模式匹配,确保目标金属保持稳定络合态而不会产生沉淀或络合物解离,通过系统排查并优化各步骤的条件,可以使离子色谱法对药物杂质的回收率普遍达到90%~110%之间,重复性RSD小于5%[9]。
3.3标准物质与质量控制
在进行药物杂质检测时标准物质的质量和来源直接影响测定的准确性和可比性。对于常见无机离子如氯离子、硫酸根离子等,通常可选用国家标准物质或经权威机构标定的参考物质;对于金属杂质如铅、镉、钯等,可使用ICP级别的金属标准溶液,根据需要进行倍比稀释,若缺乏特定有机降解产物的标准品则需自行制备或从合成商处定制并经严格表征后使用[10]。
在质量控制方面,通常在每批检测中设置空白对照、仪器检出限空白以及质量控制样品来监测方法的稳定性与灵敏度。QC样可以是含已知浓度目标杂质的模拟基质溶液,也可由当前检测的实际药物批次中选取代表性样品并以参考方法测定的结果作为对照。当在检测过程中发现QC样的测定结果偏离预期值超出控制范围,说明该方法可能出现系统误差或仪器故障,需要及时采取纠正措施[11]。
为了保障实验室间结果的一致性,药典或ICH指南也鼓励采用能力验证或实验室间比对的方式对检测结果进行客观评估。离子色谱法因其在阴离子、阳离子等杂质检测中的特异优势,被越来越多地纳入法定标准方法体系。随着近几年对杂质分析要求的提升以及标准物质研制水平的进步,离子色谱法的质量控制体系也愈加健全,在药品研发、生产及监管等多环节均发挥着不可或缺的作用[12]。
4结论
综上所述,离子色谱法在药物杂质检测中具有高灵敏度、高选择性和多模式联用的独特优势。通过合理的固定相、流动相和前处理策略选择,针对无机杂质、有机酸降解产物以及金属离子等不同类型杂质开展针对性分析,可满足药品质量控制的多重需求。同时,IC与ICP-MS、高分辨质谱等的联用,使微量及结构复杂的杂质得到更准确的定量定性。随着二维色谱、在线富集等技术的不断发展,离子色谱法在方法学优化、检测限提升以及质量控制标准化等方面仍具备很大潜
力,为未来药物研发与生产的高质量发展提供更有力的技术支撑。